铁死亡作为一种新型程序性细胞死亡方式,能够增强晚期前列腺癌细胞对治疗药物的反应敏感性。电压依赖性阴离子通道1(VDAC1),作为线粒体外膜的关键组成部分,对维持线粒体稳态及调控多种细胞死亡模式起着至关重要的作用。然而,VDAC1在调控前列腺癌细胞铁死亡过程中的具体机制仍不明确。近期,我校生命科学学院高平教授的研究团队在《Nature Communications》期刊上发表了一篇题为“VSTM2L protects prostate cancer cells against ferroptosis via inhibiting VDAC1 oligomerization and maintaining mitochondria homeostasis”的研究论文。该研究深入阐述了线粒体定位的VSTM2L蛋白通过抑制VDAC1的寡聚化过程,从而调节前列腺癌细胞铁死亡的分子机制,并强调了VSTM2L作为前列腺癌治疗新靶标的潜力。
本研究综合运用分子生物学技术、细胞生物学方法及动物模型实验,深入探究了VDAC1的互作蛋白VSTM2L在前列腺癌中的特定功能及分子调控机制,并得出以下关键结论:(1)明确了VDAC1与VSTM2L存在直接的相互作用,且VSTM2L主要定位于前列腺癌细胞的线粒体中;(2)VSTM2L在前列腺癌组织样本中显著高表达,其过表达可促进前列腺癌细胞的增殖与迁移能力;(3)通过VSTM2L敲低实验,发现前列腺癌细胞呈现出明显的形态收缩、线粒体皱缩及膜密度增加等特征,同时伴随着谷胱甘肽(GSH)水平及谷胱甘肽过氧化物酶4(GPX4)蛋白表达的显著下降,这些变化提示VSTM2L敲低可诱导前列腺癌细胞发生铁死亡;(4)进一步研究表明,VSTM2L、VDAC1及己糖激酶2(HK2)可形成复合体结构,VSTM2L敲低可导致VDAC1与HK2的解离,进而促进VDAC1的寡聚化,这一过程扰乱了线粒体的稳态,最终诱导前列腺癌细胞发生铁死亡并抑制前列腺癌的进展(图一)。该成果首次揭示了VDAC1的互作蛋白VSTM2L在前列腺癌细胞中介导铁死亡调控的分子机制,拓展了对VDAC1寡聚化在铁死亡调节中的理论认知,并为前列腺癌的临床治疗策略提供了潜在的分子靶点。
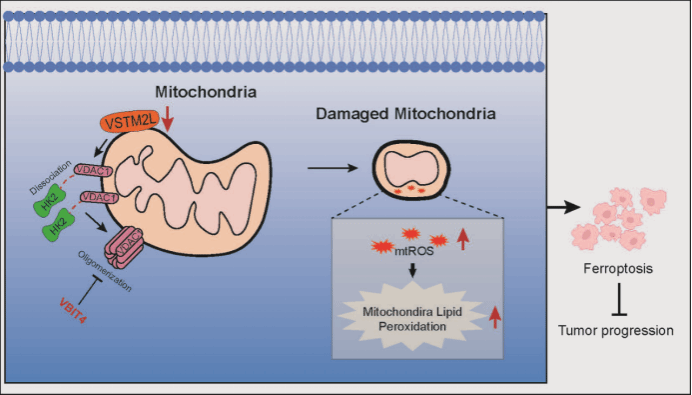
图一 VSTM2L调节前列腺癌细胞铁死亡的模式示意图
我院博士研究生杨娟和硕士研究生鲁晓为该文章的共同第一作者,学院教师高平和董小明为本论文的共同通讯作者。本研究工作得到了陕西师范大学实验动物中心以及生命科学学院公共实验平台的支持,同时受到国家自然科学基金,陕西省自然科学基金、中央高校基本科研专项资金以及陕西师范大学研究生领航人才培养项目的资助。
论文链接:https://www.nature.com/articles/s41467-025-56494-6

